La química británica Dorothy Mary Crowfoot-Hodgkin nació en El Cairo en 1910, en una época en la que Egipto era una colonia británica. No fue una mujer que destacase por un solo descubrimiento, sino por un conjunto de logros, todos relacionados con un campo común: la cristalografía de rayos X.
La cristalografía de rayos X: el descubrimiento revolucionario
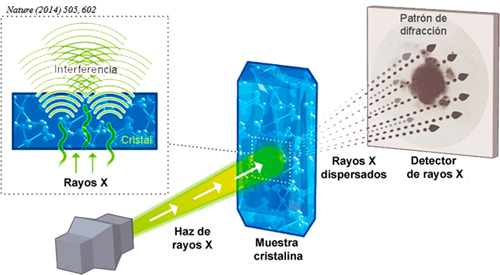
El libro de Bragg que leyó Dorothy mostraba cómo “ver” los átomos y moléculas dentro de una estructura tridimensional formada por cristales, gracias a la cristalografía de rayos X. En esta técnica, se hacen pasar rayos X a través de un material cristalino y se proyecta una imagen con puntos que forman un patrón. El estudio de este patrón revela la estructura tridimensional del material. William Henry Bragg ganó el Premio Nobel de Física en 1915 por sus contribuciones en este campo. Pronto surgió interés por esta técnica en biología, ya que se sospechaba que las biomoléculas también podrían tener estructuras tridimensionales similares a los cristales simples. Aquí fue donde Dorothy jugó un papel crucial, hasta ganar el Premio Nobel de Química en 1964 “por la determinación de la estructura de numerosas sustancias biológicas mediante los rayos X.” No fue una sola molécula, sino varias.
Dorothy realizó sus estudios de química en la Universidad de Oxford entre 1928 y 1932. Tuvo la oportunidad de asistir a una conferencia del cristalógrafo John Desmond Bernal, conocido por ser el autor de Historia social de la ciencia. Unirse al laboratorio de Bernal en Cambridge fue el impulso que necesitaba para especializarse en cristalografía de rayos X aplicada a la biología. Su mentor defendía la coeducación, una idea que comenzaba a ganar relevancia, aunque las mujeres aún enfrentaban muchas dificultades. Tras completar su doctorado en 1934, volvió a Oxford, donde investigó en su especialidad hasta el final de sus días, destacando en un contexto científico predominantemente masculino.
El libro de Bragg que leyó Dorothy mostraba cómo “ver” los átomos y moléculas dentro de una estructura tridimensional formada por cristales, gracias a la cristalografía de rayos X. En esta técnica, se hacen pasar rayos X a través de un material cristalino y se proyecta una imagen con puntos que forman un patrón. El estudio de este patrón revela la estructura tridimensional del material. William Henry Bragg ganó el Premio Nobel de Física en 1915 por sus contribuciones en este campo. Pronto surgió interés por esta técnica en biología, ya que se sospechaba que las biomoléculas también podrían tener estructuras tridimensionales similares a los cristales simples. Aquí fue donde Dorothy jugó un papel crucial, hasta ganar el Premio Nobel de Química en 1964 “por la determinación de la estructura de numerosas sustancias biológicas mediante los rayos X.” No fue una sola molécula, sino varias.
Dorothy realizó sus estudios de química en la Universidad de Oxford entre 1928 y 1932. Tuvo la oportunidad de asistir a una conferencia del cristalógrafo John Desmond Bernal, conocido por ser el autor de Historia social de la ciencia. Unirse al laboratorio de Bernal en Cambridge fue el impulso que necesitaba para especializarse en cristalografía de rayos X aplicada a la biología. Su mentor defendía la coeducación, una idea que comenzaba a ganar relevancia, aunque las mujeres aún enfrentaban muchas dificultades. Tras completar su doctorado en 1934, volvió a Oxford, donde investigó en su especialidad hasta el final de sus días, destacando en un contexto científico predominantemente masculino.
Las moléculas que cambiaron la historia
Dorothy logró desvelar la estructura tridimensional de varias biomoléculas: colesterol (1937), penicilina (1945), vitamina B12 (1954) e insulina (1969). Lawrence Bragg, hijo de William Henry Bragg, afirmó que su trabajo sobre la vitamina B12 era tan significativo “como romper la barrera del sonido.” Respecto a la insulina, dedicó treinta y cinco años a su estudio, mejorando sus métodos para poder determinar su estructura molecular, una sustancia que consideraba fascinante y sobre la que ofreció numerosas conferencias alrededor del mundo.
La penicilina ocupa un lugar especial en los estudios de Dorothy, ya que se enamoró de esta molécula al conocer que podía curar ratones infectados por bacterias. Estaba convencida de que conocer su estructura tridimensional permitiría fabricar penicilina en grandes cantidades, y acertó. Estudió la penicilina en la década de 1940 utilizando los primeros ordenadores, que ocupaban habitaciones enteras, lo que la convirtió en una pionera en este ámbito.
Una pionera incansable hasta el final
Nuestra protagonista no solo fue una luchadora en la ciencia. Desde los veinticuatro años fue diagnosticada con artrosis severa, que afectó sus manos y pies. En esa época no había tratamiento para la artrosis, por lo que sufrió en silencio el dolor, mientras sus manos se deformaban progresivamente. No obstante, continuó escribiendo a mano todo lo que podía, adaptando su caligrafía para no mostrar sus dificultades. Incluso cuando se retiró en 1977, siguió viajando y dando conferencias, ya desplazándose en silla de ruedas debido a su enfermedad. Antes de ello, Dorothy fue madre de tres hijos y no permitió que la maternidad la alejase de su pasión por los cristales.
Por su trabajo incansable, fue reconocida en vida, como muestra su inclusión en la Real Sociedad de Londres a los treinta y siete años, siendo la tercera mujer en ser aceptada como miembro en casi trescientos años de existencia. Dorothy Crowfoot-Hodgkin falleció el 29 de julio de 1994 a los ochenta y siete años.
Dorothy logró desvelar la estructura tridimensional de varias biomoléculas: colesterol (1937), penicilina (1945), vitamina B12 (1954) e insulina (1969). Lawrence Bragg, hijo de William Henry Bragg, afirmó que su trabajo sobre la vitamina B12 era tan significativo “como romper la barrera del sonido.” Respecto a la insulina, dedicó treinta y cinco años a su estudio, mejorando sus métodos para poder determinar su estructura molecular, una sustancia que consideraba fascinante y sobre la que ofreció numerosas conferencias alrededor del mundo.
La penicilina ocupa un lugar especial en los estudios de Dorothy, ya que se enamoró de esta molécula al conocer que podía curar ratones infectados por bacterias. Estaba convencida de que conocer su estructura tridimensional permitiría fabricar penicilina en grandes cantidades, y acertó. Estudió la penicilina en la década de 1940 utilizando los primeros ordenadores, que ocupaban habitaciones enteras, lo que la convirtió en una pionera en este ámbito.
Una pionera incansable hasta el final
Nuestra protagonista no solo fue una luchadora en la ciencia. Desde los veinticuatro años fue diagnosticada con artrosis severa, que afectó sus manos y pies. En esa época no había tratamiento para la artrosis, por lo que sufrió en silencio el dolor, mientras sus manos se deformaban progresivamente. No obstante, continuó escribiendo a mano todo lo que podía, adaptando su caligrafía para no mostrar sus dificultades. Incluso cuando se retiró en 1977, siguió viajando y dando conferencias, ya desplazándose en silla de ruedas debido a su enfermedad. Antes de ello, Dorothy fue madre de tres hijos y no permitió que la maternidad la alejase de su pasión por los cristales.
Por su trabajo incansable, fue reconocida en vida, como muestra su inclusión en la Real Sociedad de Londres a los treinta y siete años, siendo la tercera mujer en ser aceptada como miembro en casi trescientos años de existencia. Dorothy Crowfoot-Hodgkin falleció el 29 de julio de 1994 a los ochenta y siete años.
El legado de la cristalografía de rayos X y su evolución hasta hoy
El trabajo de Dorothy Crowfoot-Hodgkin marcó un punto de inflexión en la cristalografía de rayos X, abriendo nuevas posibilidades para explorar las estructuras de moléculas biológicas complejas. A partir de sus descubrimientos, la técnica se perfeccionó y comenzó a aplicarse en un rango mucho más amplio de investigaciones. Durante las décadas posteriores, los avances en computación permitieron analizar los patrones de difracción de forma más precisa y rápida, reduciendo significativamente el tiempo necesario para resolver estructuras tridimensionales. Este progreso fue clave para el desarrollo de la biología estructural moderna.
En la actualidad, la cristalografía de rayos X se ha convertido en una herramienta esencial para la ciencia, especialmente en el ámbito de la biomedicina. Los científicos la utilizan para estudiar proteínas complejas, como las enzimas y los receptores celulares, que juegan un papel crucial en enfermedades como el cáncer o el Alzheimer. La técnica ha sido fundamental para diseñar fármacos más efectivos, ya que permite visualizar exactamente cómo una molécula terapéutica interactúa con su objetivo. Incluso con la llegada de métodos alternativos, como la criomicroscopía electrónica, la cristalografía sigue siendo el estándar para obtener imágenes de alta resolución a nivel atómico.
La técnica ha trascendido el ámbito de la biología. Hoy se utiliza en el estudio de materiales avanzados, como superconductores y nanomateriales, que requieren un conocimiento detallado de sus estructuras cristalinas. Estos análisis contribuyen a desarrollar tecnologías en campos tan diversos como la energía renovable, la electrónica y la ciencia de los materiales. El legado de la cristalografía de rayos X es evidente en la enorme cantidad de descubrimientos científicos que se han logrado desde los primeros pasos de Dorothy, mostrando cómo una técnica que comenzó como una herramienta de laboratorio se ha convertido en un pilar fundamental de la investigación científica moderna.
El trabajo de Dorothy Crowfoot-Hodgkin marcó un punto de inflexión en la cristalografía de rayos X, abriendo nuevas posibilidades para explorar las estructuras de moléculas biológicas complejas. A partir de sus descubrimientos, la técnica se perfeccionó y comenzó a aplicarse en un rango mucho más amplio de investigaciones. Durante las décadas posteriores, los avances en computación permitieron analizar los patrones de difracción de forma más precisa y rápida, reduciendo significativamente el tiempo necesario para resolver estructuras tridimensionales. Este progreso fue clave para el desarrollo de la biología estructural moderna.
En la actualidad, la cristalografía de rayos X se ha convertido en una herramienta esencial para la ciencia, especialmente en el ámbito de la biomedicina. Los científicos la utilizan para estudiar proteínas complejas, como las enzimas y los receptores celulares, que juegan un papel crucial en enfermedades como el cáncer o el Alzheimer. La técnica ha sido fundamental para diseñar fármacos más efectivos, ya que permite visualizar exactamente cómo una molécula terapéutica interactúa con su objetivo. Incluso con la llegada de métodos alternativos, como la criomicroscopía electrónica, la cristalografía sigue siendo el estándar para obtener imágenes de alta resolución a nivel atómico.
La técnica ha trascendido el ámbito de la biología. Hoy se utiliza en el estudio de materiales avanzados, como superconductores y nanomateriales, que requieren un conocimiento detallado de sus estructuras cristalinas. Estos análisis contribuyen a desarrollar tecnologías en campos tan diversos como la energía renovable, la electrónica y la ciencia de los materiales. El legado de la cristalografía de rayos X es evidente en la enorme cantidad de descubrimientos científicos que se han logrado desde los primeros pasos de Dorothy, mostrando cómo una técnica que comenzó como una herramienta de laboratorio se ha convertido en un pilar fundamental de la investigación científica moderna.


No hay comentarios:
Publicar un comentario