A finales del siglo XVIII Joseph Louis Proust era profesor de química en Segovia, y en su bien equipado laboratorio realizó muchas de las experiencias que le llevaron a formular la llamada Ley de las proporciones constantes.
Observó que cuando dos o más elementos se combinan para dar un compuesto determinado lo hacen siempre en la misma proporción de pesos. Por ejemplo, siempre que el carbono se combina con oxígeno para dar el gas que Joseph Black había llamado «aire fijo» en 1754, lo hacen en una proporción de 3 a 8. Pero esos dos elementos pueden dar lugar también a otro gas a todas luces diferente, que resultaba altamente tóxico, en el que la proporción era de 3 a 4. La formación de compuestos distintos entre dos elementos determinados interesó a John Dalton, quien en Manchester estudió comparativamente las proporciones de pesos en esos casos, concluyendo que al final había una relación de números enteros sencillos, en un enunciado que se conoce como Ley de las proporciones múltiples. Esas y otras realidades experimentales le sirvieron para elaborar una teoría atómica que supuso un hito en la historia de la química.
En el primer decenio del siglo XIX Dalton fue aquilatando una teoría según la cual los compuestos químicos tienen lugar por agrupación de átomos diferentes ,y fue el primero en publicar una tabla de pesos relativos y símbolos de unos cuantos elementos. En su teoría toma de los antiguos filósofos la idea de átomos indivisibles, afirmando que los de un elemento son iguales entre sí, y que difieren de unos elementos a otros en su peso. Los compuestos estarían formados por moléculas, cada una de las cuales contiene átomos de varios elementos. En su obra Un nuevo sistema de filosofía química (1808) especifica que puede haber compuestos binarios, ternarios, etc., en función del número de átomos que contiene cada molécula. Todavía faltaba mucho para entender el porqué se formaban unos compuestos y otros no. La clave para ello se encuentra en un concepto que a finales de siglo llegaría a conocerse como valencia.
De las pocas cosas de química que se aprendían hasta nuestros días en la enseñanza obligatoria, la más común era la idea de valencia. Era necesario saber de memoria las correspondientes a cada elemento químico, de modo que el alumnado fuese capaz de escribir las fórmulas de cualquier compuesto imaginable, al margen de su interés. Evidentemente, no era el mejor camino para enamorarse de la asignatura. La historia del concepto de valencia se inicia con un profesor de química en Glasgow, Thomas Thomson, quien en su estudio sobre la teoría de Dalton (1813) imaginó que los átomos de cada elemento tienen un número característico de puntos de unión, con los cuales forman los enlaces.
Tuvieron que pasar algunas décadas hasta que el 10 de mayo de 1852 el joven profesor Edward Frankland presentó en la Royal Society londinense un trabajo sobre una especialidad en la que era pionero, los compuestos organometálicos, donde establecía que cada átomo puede combinarse con un número limitado de otros, expresando así su poder combinante, o atomicidad, concepto que más tarde el químico alemán Richard Abegg comenzó a denominar valencia.
Frankland llegó a la conclusión de que la atomicidad del hidrógeno era siempre uno y en función de ello atribuía números a los elementos (tres para el nitrógeno, dos para el azufre…), encontrando que algunos de los elementos podían tener varias atomicidades diferentes.
El concepto de valencia fue de gran ayuda a la hora de explicar la estructura de compuestos estudiados, tanto en la química del carbono como en la llamada química inorgánica. El primer científico en plasmar gráficamente estructuras moleculares fue el escocés Alexander Crum Brown (1864). El químico orgánico representaba los átomos con símbolos rodeados por un círculo, y los unía con segmentos que representaban las valencias. Los avances en el conocimiento del interior de los átomos desde comienzos del siglo XX han permitido comprender el enlace químico, tanto para los compuestos que tienen estructura molecular como para los que forman redes de cualquier tipo. La palabra valencia ha pasado a ser un complemento (electrones de valencia, orbitales de valencia, …) para referirse a la parte del átomo que se ve implicada en los enlaces químicos.
En el primer decenio del siglo XIX Dalton fue aquilatando una teoría según la cual los compuestos químicos tienen lugar por agrupación de átomos diferentes ,y fue el primero en publicar una tabla de pesos relativos y símbolos de unos cuantos elementos. En su teoría toma de los antiguos filósofos la idea de átomos indivisibles, afirmando que los de un elemento son iguales entre sí, y que difieren de unos elementos a otros en su peso. Los compuestos estarían formados por moléculas, cada una de las cuales contiene átomos de varios elementos. En su obra Un nuevo sistema de filosofía química (1808) especifica que puede haber compuestos binarios, ternarios, etc., en función del número de átomos que contiene cada molécula. Todavía faltaba mucho para entender el porqué se formaban unos compuestos y otros no. La clave para ello se encuentra en un concepto que a finales de siglo llegaría a conocerse como valencia.
De las pocas cosas de química que se aprendían hasta nuestros días en la enseñanza obligatoria, la más común era la idea de valencia. Era necesario saber de memoria las correspondientes a cada elemento químico, de modo que el alumnado fuese capaz de escribir las fórmulas de cualquier compuesto imaginable, al margen de su interés. Evidentemente, no era el mejor camino para enamorarse de la asignatura. La historia del concepto de valencia se inicia con un profesor de química en Glasgow, Thomas Thomson, quien en su estudio sobre la teoría de Dalton (1813) imaginó que los átomos de cada elemento tienen un número característico de puntos de unión, con los cuales forman los enlaces.
Tuvieron que pasar algunas décadas hasta que el 10 de mayo de 1852 el joven profesor Edward Frankland presentó en la Royal Society londinense un trabajo sobre una especialidad en la que era pionero, los compuestos organometálicos, donde establecía que cada átomo puede combinarse con un número limitado de otros, expresando así su poder combinante, o atomicidad, concepto que más tarde el químico alemán Richard Abegg comenzó a denominar valencia.
Frankland llegó a la conclusión de que la atomicidad del hidrógeno era siempre uno y en función de ello atribuía números a los elementos (tres para el nitrógeno, dos para el azufre…), encontrando que algunos de los elementos podían tener varias atomicidades diferentes.
El concepto de valencia fue de gran ayuda a la hora de explicar la estructura de compuestos estudiados, tanto en la química del carbono como en la llamada química inorgánica. El primer científico en plasmar gráficamente estructuras moleculares fue el escocés Alexander Crum Brown (1864). El químico orgánico representaba los átomos con símbolos rodeados por un círculo, y los unía con segmentos que representaban las valencias. Los avances en el conocimiento del interior de los átomos desde comienzos del siglo XX han permitido comprender el enlace químico, tanto para los compuestos que tienen estructura molecular como para los que forman redes de cualquier tipo. La palabra valencia ha pasado a ser un complemento (electrones de valencia, orbitales de valencia, …) para referirse a la parte del átomo que se ve implicada en los enlaces químicos.
¿Qué es valencia?
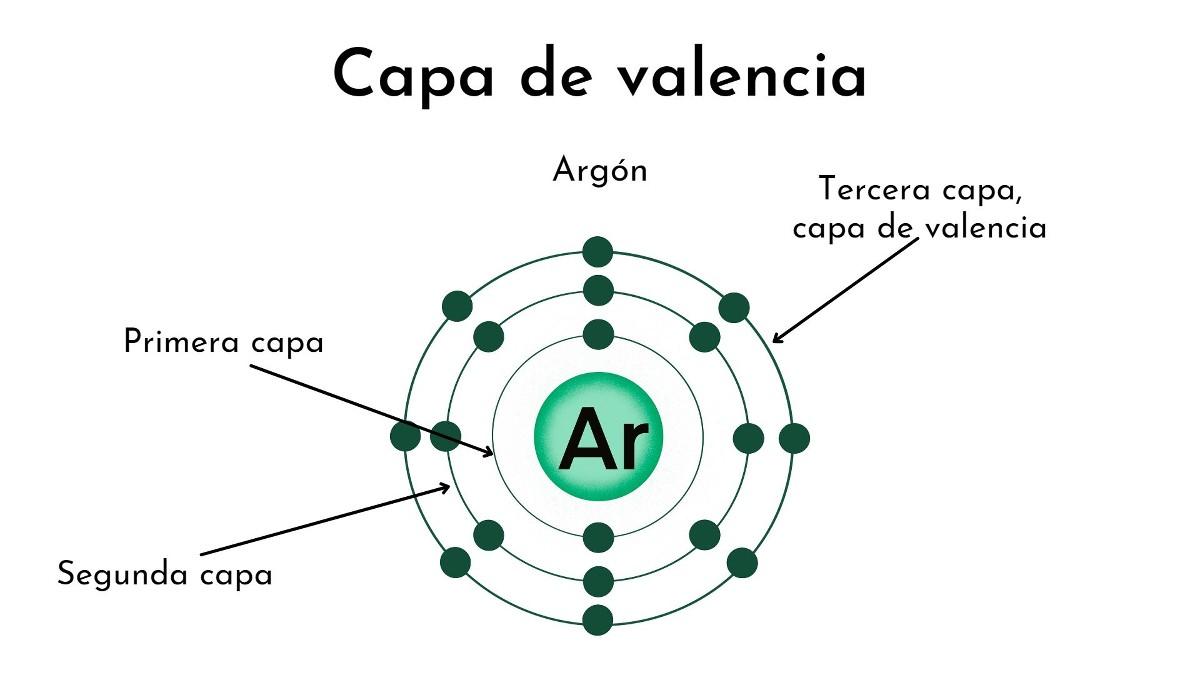
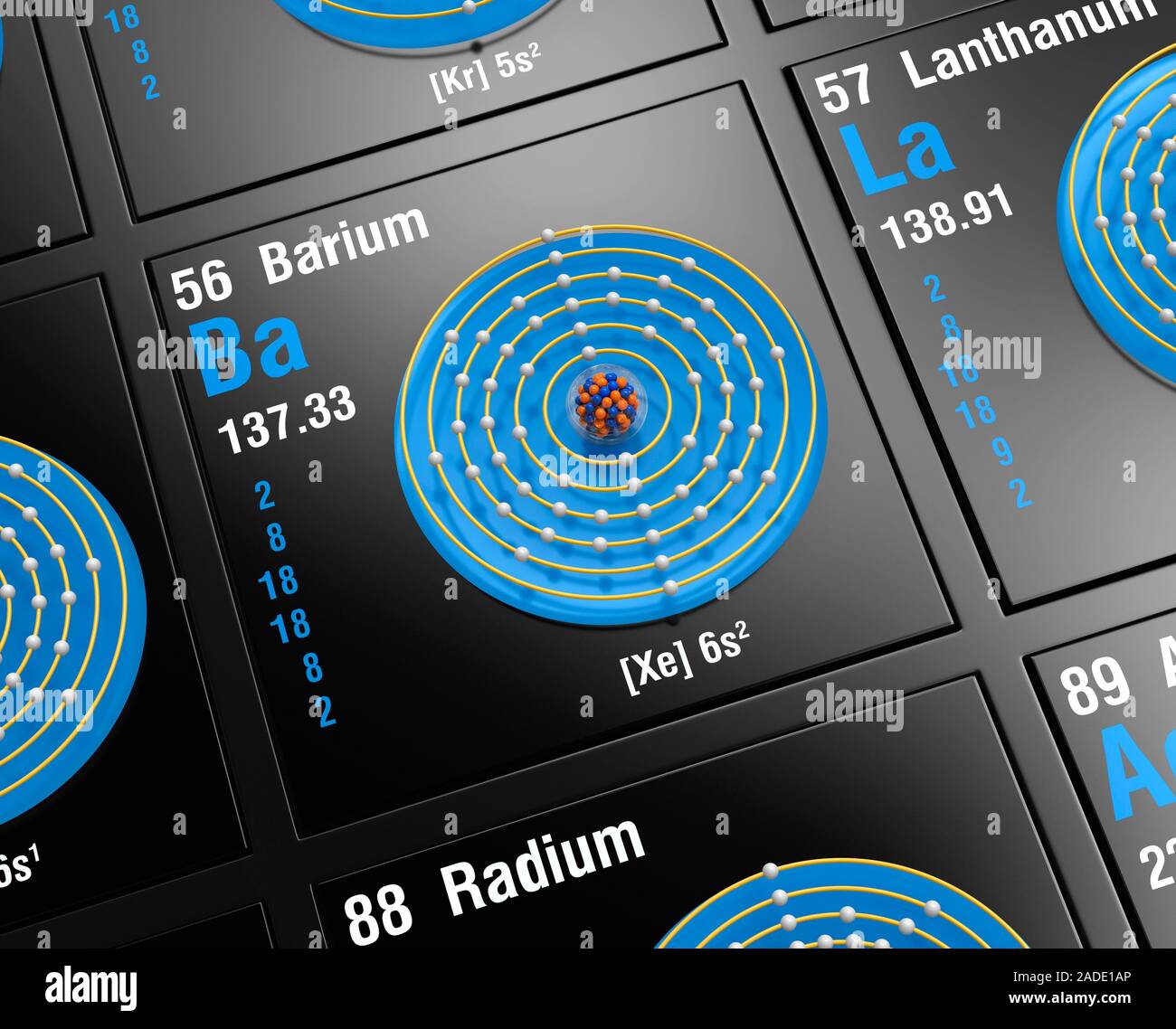
En química, hablamos de valencia para referirnos al número de electrones que un átomo de un elemento químico determinado posee en su último nivel de energía.Otra forma de interpretar la valencia es como el número de electrones que un átomo de un determinado elemento químico debe ceder o aceptar para completar su último nivel de energía. Estos electrones son de especial relevancia, pues son los responsables de la formación de los enlaces químicos, por ejemplo, los enlaces covalentes (co-valente: comparten valencia). Son estos electrones los que intervienen en las reacciones químicas.
Un átomo puede tener una o más valencias. Por ese motivo este concepto (creado en el siglo XIX para explicar las “afinidades” entre los distintos átomos que se conocían) ha sido sustituido con el de “número de oxidación”, que finalmente representa prácticamente lo mismo.
Por ejemplo, el átomo de hidrógeno tiene valencia 1, lo que significa que puede compartir un electrón en su última capa; el de carbono, en cambio, tiene valencia 2 o 4, es decir, puede ceder dos o cuatro electrones. De allí que el número de valencia representa la capacidad del elemento de ganar o ceder electrones durante una reacción o enlace químico.
A lo largo de la historia, el concepto de valencia permitió el desarrollo de teorías respecto a los enlaces químicos, como son:
Un átomo puede tener una o más valencias. Por ese motivo este concepto (creado en el siglo XIX para explicar las “afinidades” entre los distintos átomos que se conocían) ha sido sustituido con el de “número de oxidación”, que finalmente representa prácticamente lo mismo.
Por ejemplo, el átomo de hidrógeno tiene valencia 1, lo que significa que puede compartir un electrón en su última capa; el de carbono, en cambio, tiene valencia 2 o 4, es decir, puede ceder dos o cuatro electrones. De allí que el número de valencia representa la capacidad del elemento de ganar o ceder electrones durante una reacción o enlace químico.
A lo largo de la historia, el concepto de valencia permitió el desarrollo de teorías respecto a los enlaces químicos, como son:
Estructura de Lewis (1916). Es una representación bidimensional de las moléculas o los iones, donde los enlaces covalentes son representados por guiones y los electrones no compartidos por puntos. En caso de que existan en las estructuras pares de electrones solitarios, son representados por dos puntos.
La teoría del enlace de valencia (1927). Esta teoría plantea que el átomo central en una molécula tiende a formar pares de electrones, lo cual depende de limitaciones geométricas de la molécula y del cumplimiento de la regla del octeto (los iones de los elementos químicos tienen a completar su último nivel de energía con 8 electrones para alcanzar una configuración más estable).
La teoría de los orbitales moleculares (1928). Según esta teoría, los electrones no están asignados a enlaces individuales entre átomos (como se plantea en la estructura de Lewis), sino que dichos electrones se mueven por toda la molécula bajo la influencia de los núcleos atómicos.
La teoría de repulsión de pares electrónicos de la capa de valencia (1958). Esta teoría se basa en la repulsión electrostática de los electrones de valencia de un átomo, que se repelen mutuamente hasta alcanzar una disposición en el espacio, donde finalmente no se repelen más y se define en esta configuración la geometría de la molécula.
Tipos de valencia
Existen dos tipos distintos de valencia:
Existen dos tipos distintos de valencia:
Valencia positiva máxima. Refleja la máxima capacidad combinatoria de un átomo, es decir, la mayor cantidad de electrones que puede ceder. Los electrones tienen carga negativa, así que un átomo que los cede obtiene una valencia positiva (+).
Valencia negativa. Representa la capacidad de un átomo de combinarse con otro que presente valencia positiva. Los átomos que reciben electrones presentan una valencia negativa (-).
Valencia de los elementos
Las valencias conocidas de algunos elementos de la tabla periódica son las siguientes:Hidrógeno (H): 1
Carbono (C): 2, 4
Sodio (Na): 1
Potasio (K): 1
Aluminio (Al): 3
Mercurio (Hg): 1, 2
Calcio (Ca): 2
Hierro (Fe): 2, 3
Plomo (Pb): 2, 4
Cromo (Cr): 2, 3, 6
Manganeso (Mn): 2, 3, 4, 6, 7
Cloro (Cl): 1, 3, 5, 7
Oxígeno (O): 1,2
Azufre (S): 2, 4, 6
Nitrógeno (N): 1, 2, 3, 4, 5
Arsénico (As): 3, 5
Boro (B): 3
Silicio (Si): 4
Oro (Au): 1, 3
Plata (Ag): 1
Fósforo (P): 3, 5
Radio (Ra): 2
Magnesio (Mg): 2
Cobre (Cu): 1, 2
Las valencias conocidas de algunos elementos de la tabla periódica son las siguientes:Hidrógeno (H): 1
Carbono (C): 2, 4
Sodio (Na): 1
Potasio (K): 1
Aluminio (Al): 3
Mercurio (Hg): 1, 2
Calcio (Ca): 2
Hierro (Fe): 2, 3
Plomo (Pb): 2, 4
Cromo (Cr): 2, 3, 6
Manganeso (Mn): 2, 3, 4, 6, 7
Cloro (Cl): 1, 3, 5, 7
Oxígeno (O): 1,2
Azufre (S): 2, 4, 6
Nitrógeno (N): 1, 2, 3, 4, 5
Arsénico (As): 3, 5
Boro (B): 3
Silicio (Si): 4
Oro (Au): 1, 3
Plata (Ag): 1
Fósforo (P): 3, 5
Radio (Ra): 2
Magnesio (Mg): 2
Cobre (Cu): 1, 2



No hay comentarios:
Publicar un comentario