Tenemos cerebros extravagantemente grandes que nos permiten construir complicados artefactos, entender conceptos abstractos y comunicarnos usando el lenguaje.
También somos casi lampiños, tenemos mandíbulas débiles y nos cuesta dar a luz. ¿Cómo evolucionó una criatura tan estrafalaria?
1 - Vivir en grupo

Hace 60-30 millones de años
Los primeros primates, el grupo que incluye a monos y humanos, evolucionaron poco después de la desaparición de los dinosaurios.
Muchos comenzaron rápidamente a vivir en grupos. Eso supuso que cada animal debía moverse en una compleja red de amistades, jerarquías y rivalidades.
Así que vivir en grupos puede haber impulsado un aumento sostenido de la capacidad intelectual.
2- Más sangre al cerebro
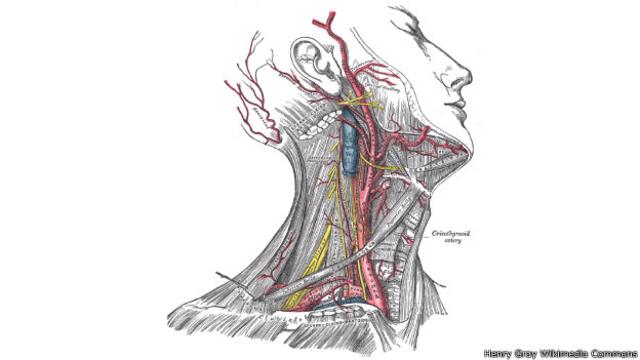
Hace 15-10 millones de años
Humanos, chimpancés y gorilas descienden todos de una especie desconocida de homínido extinguida.
En este ancestro, un gen llamado RNF213 comenzó a evolucionar rápidamente.
Esto puede haber estimulado el flujo de sangre hacia el cerebro al ensanchar la arteria carótida.
En humanos, las mutaciones de RNF213 causan la enfermedad de Moyamoya, en la que la arteria es demasiado estrecha, una condición que conduce al deterioro de la capacidad cerebral por falla de irrigación.
3 – La división de los primates: primeros cambios de genes

Hace 13-7 millones de años
Nuestros ancestros se separaron de sus parientes parecidos a los chimpacés hace unos 7 millones de años.
En un principio, tendrían una apariencia similar. Pero dentro de sus células, el cambio ya estaba en marcha.
Después de la división, los genes ASPM y ARHGAP11B empezaron a mutar, así como un segmento del genoma humano denominado región HAR1.
No está claro que provocó estas modificaciones, pero HAR1 y ARHGAP11B están involucrados en el crecimiento del córtex cerebral.
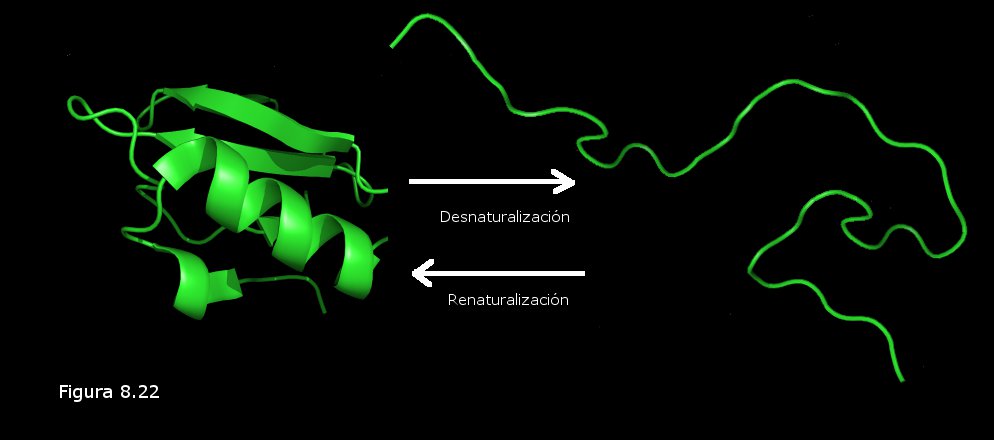
4 – Subidón de azúcar: energía para el cerebro
Hace menos de 7 millones de años
Después de que la línea evolutiva humana se separó de la línea de los chimpancés, dos genes mutaron.
SLC2A1 y SLC2A4 forman proteínas que transportan glucosa dentro y fuera de las células.
Las modificaciones pueden haber desviado glucosa de los músculos hacia el cerebro de aquellos homínidos primitivos, y es posible que esta glucosa los haya estimulado y permitido que crecieran los cerebros.
5 – Las manos más hábiles
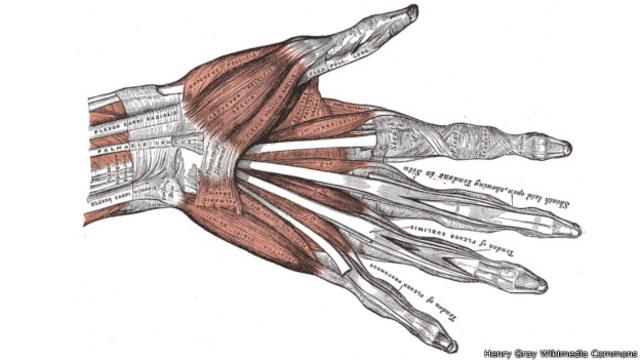
Hace menos de 7 millones de años
Nuestras manos son inusualmente hábiles y nos permiten hacer bellas herramientas de piedra o escribir palabras.
Eso puede deberse en parte a un fragmento de ADN llamado HACNS1, que ha evolucionado rápidamente desde que nuestros ancestros se dividieron de los ancestros de los chimpancés.
No sabemos qué hace HACNS1, pero se activa cuando se desarrollan nuestros brazos y manos.
6 – Mandíbulas débiles: más lugar para el cerebro
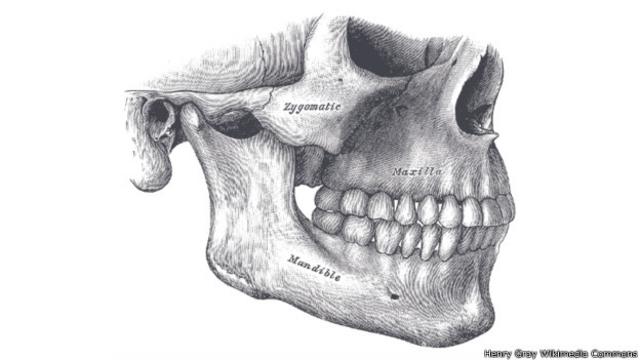
Hace 5,3 - 2,4 millones de años
En comparación con otros primates, los humanos no pueden morder con demasiada fuerza porque tienen músculos delgados en la mandíbula.
Esto parece deberse fundamentalmente a una mutación del gen MYH16, que controla producción de tejido muscular.
Este cambio ocurrió hace entre 5,3 y 2,4 millones de años. Las mandíbulas más pequeñas pueden haber liberado espacio para que crezca el cerebro.
7 – Dieta variada: carne en el menú

Hace 3,5 – 1,8 millones de años
Nuestros ancestros primates más antiguos comían principalmente fruta, pero especies posteriores como el Australopithecus ampliaron su gusto.
Además de alimentarse con una variedad más grande de plantas, como las hierbas, parece que comieron mucha más carne e incluso que la troceaban con herramientas de piedra.
Más carne supuso más calorías y menos tiempo de masticación.
8 – Pelados: no más vello corporal

Hace 3,3 millones de años
Los humanos son primates casi lampiños. Nadie sabe por qué, pero ocurrió hace entre 3 y 4 millones de años.
Fue entonces fue cuando evolucionaron las ladillas, que solo pudieron infectar el pubis cuando el resto del pelo había desaparecido.
Expuesta al sol, la piel se oscureció. A partir de entonces, todos nuestros ancestros fueron negros, hasta que algunos humanos modernos dejaron los trópicos.
9 - Conexiones: un gen de inteligencia
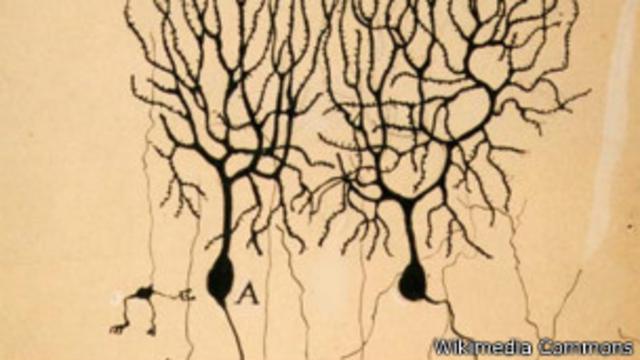
Hace 3,2 – 2,5 millones de años
Un gen llamado SRGAP2 fue duplicado tres veces.
Como resultado, nuestros ancestros tuvieron varias copias, algunas de las cuales podrían haber evolucionado libremente.
Una de las copias mutadas resultó ser mejor que la original.
Es probable que haya provocado que las células del cerebro modelaran más prolongaciones, permitiéndoles formar más conexiones.
10 – Cerebros más grandes: primates pensantes

Hace 2,8 millones de años
Los humanos modernos pertenecen a un grupo o género de animales conocido como Homo.
El fósil de Homo más antiguo conocido fue hallado en Etiopía y tiene 2,8 millones de años.
La primera especie fue probablemente Homo habilis, aunque este supuesto ha sido disputado.
En comparación con sus ancestros, estos nuevos homínidos tenían cerebros mucho más grandes.
11 – Parto complicado: una cabeza muy grande
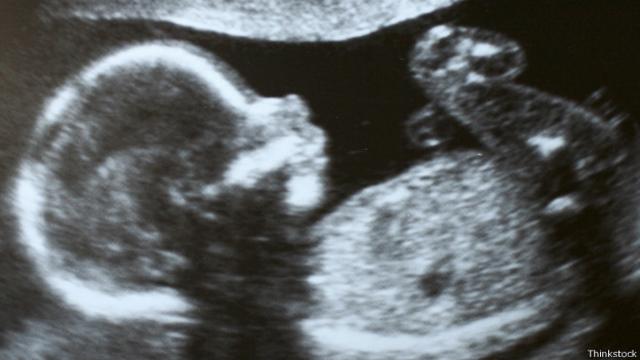
Hace 2,5 millones – 200.000 años
Para los humanos, el parto es difícil y peligroso.
A diferencia de otros primates, las madres casi siempre necesitan ayuda.
Esto es porque caminar en dos piernas supone un canal pélvico más estrecho para el paso de un bebé humano, cuya cabeza ha crecido en relación a sus ancestros.
Para compensar el parto dificultoso, los bebés nacen más pequeños e indefensos.
12 - Control del fuego

¿Hace 1 millón de años?
Nadie sabe cuándo nuestros ancestros aprendieron a controlar el fuego.
La prueba directa más antigua proviene de la Cueva Wonderwerk, en Sudáfrica, que contiene cenizas y huesos quemados de hace 1 millón de años.
Pero hay evidencias de que los homínidos procesaban los alimentos incluso antes y de que eso podía incluir cocinar con fuego.
13 – El don de la charla
Hace 1,6 millones – 600.000
Todos los grandes homínidos tienen sacos de aire en sus tractos vocales que les permiten lanzar fuertes bramidos.
Pero los humanos no, porque esos sacos de aire hacen que sea imposible producir diferentes sonidos vocales.
Nuestros ancestros los perdieron aparentemente antes de que nos bifurcáramos de nuestros primos Neandertales, lo que sugiere que ellos también podían hablar.
14 - Un gen para el lenguaje

Hace 500.000 años
Algunas personas tienen una mutación en un gen llamado FOXP2.
Como resultado, les cuesta entender gramática y pronunciar palabras.
Eso sugiere que FOXP2 es crucial para aprender y usar el lenguaje.
El gen moderno se desarrolló en el ancestro común de los humanos y los Neandertales: el FOXP2 neandertal es igual al nuestro.
15 – Saliva reforzada para comer carbohidratos

La saliva contiene una enzima llamada amilasa, fabricada por el gen AMY1, que digiere el almidón.
Los humanos modernos cuyos ancestros fueron agricultores tienen más copias AMY1 que aquellos cuyos ancestros siguieron siendo cazadores recolectores.
Este refuerzo digestivo puede haber ayudado para dar inicio a los cultivos, los poblados y las sociedades modernas.
Esto puede haber estimulado el flujo de sangre hacia el cerebro al ensanchar la arteria carótida.
En humanos, las mutaciones de RNF213 causan la enfermedad de Moyamoya, en la que la arteria es demasiado estrecha, una condición que conduce al deterioro de la capacidad cerebral por falla de irrigación.
3 – La división de los primates: primeros cambios de genes

Hace 13-7 millones de años
Nuestros ancestros se separaron de sus parientes parecidos a los chimpacés hace unos 7 millones de años.
En un principio, tendrían una apariencia similar. Pero dentro de sus células, el cambio ya estaba en marcha.
Después de la división, los genes ASPM y ARHGAP11B empezaron a mutar, así como un segmento del genoma humano denominado región HAR1.
No está claro que provocó estas modificaciones, pero HAR1 y ARHGAP11B están involucrados en el crecimiento del córtex cerebral.
4 – Subidón de azúcar: energía para el cerebro

Hace menos de 7 millones de años
Después de que la línea evolutiva humana se separó de la línea de los chimpancés, dos genes mutaron.
SLC2A1 y SLC2A4 forman proteínas que transportan glucosa dentro y fuera de las células.
Las modificaciones pueden haber desviado glucosa de los músculos hacia el cerebro de aquellos homínidos primitivos, y es posible que esta glucosa los haya estimulado y permitido que crecieran los cerebros.
5 – Las manos más hábiles

Hace menos de 7 millones de años
Nuestras manos son inusualmente hábiles y nos permiten hacer bellas herramientas de piedra o escribir palabras.
Eso puede deberse en parte a un fragmento de ADN llamado HACNS1, que ha evolucionado rápidamente desde que nuestros ancestros se dividieron de los ancestros de los chimpancés.
No sabemos qué hace HACNS1, pero se activa cuando se desarrollan nuestros brazos y manos.
6 – Mandíbulas débiles: más lugar para el cerebro

Hace 5,3 - 2,4 millones de años
En comparación con otros primates, los humanos no pueden morder con demasiada fuerza porque tienen músculos delgados en la mandíbula.
Esto parece deberse fundamentalmente a una mutación del gen MYH16, que controla producción de tejido muscular.
Este cambio ocurrió hace entre 5,3 y 2,4 millones de años. Las mandíbulas más pequeñas pueden haber liberado espacio para que crezca el cerebro.
7 – Dieta variada: carne en el menú

Hace 3,5 – 1,8 millones de años
Nuestros ancestros primates más antiguos comían principalmente fruta, pero especies posteriores como el Australopithecus ampliaron su gusto.
Además de alimentarse con una variedad más grande de plantas, como las hierbas, parece que comieron mucha más carne e incluso que la troceaban con herramientas de piedra.
Más carne supuso más calorías y menos tiempo de masticación.
8 – Pelados: no más vello corporal

Hace 3,3 millones de años
Los humanos son primates casi lampiños. Nadie sabe por qué, pero ocurrió hace entre 3 y 4 millones de años.
Fue entonces fue cuando evolucionaron las ladillas, que solo pudieron infectar el pubis cuando el resto del pelo había desaparecido.
Expuesta al sol, la piel se oscureció. A partir de entonces, todos nuestros ancestros fueron negros, hasta que algunos humanos modernos dejaron los trópicos.
9 - Conexiones: un gen de inteligencia

Hace 3,2 – 2,5 millones de años
Un gen llamado SRGAP2 fue duplicado tres veces.
Como resultado, nuestros ancestros tuvieron varias copias, algunas de las cuales podrían haber evolucionado libremente.
Una de las copias mutadas resultó ser mejor que la original.
Es probable que haya provocado que las células del cerebro modelaran más prolongaciones, permitiéndoles formar más conexiones.
10 – Cerebros más grandes: primates pensantes

Hace 2,8 millones de años
Los humanos modernos pertenecen a un grupo o género de animales conocido como Homo.
El fósil de Homo más antiguo conocido fue hallado en Etiopía y tiene 2,8 millones de años.
La primera especie fue probablemente Homo habilis, aunque este supuesto ha sido disputado.
En comparación con sus ancestros, estos nuevos homínidos tenían cerebros mucho más grandes.
11 – Parto complicado: una cabeza muy grande

Hace 2,5 millones – 200.000 años
Para los humanos, el parto es difícil y peligroso.
A diferencia de otros primates, las madres casi siempre necesitan ayuda.
Esto es porque caminar en dos piernas supone un canal pélvico más estrecho para el paso de un bebé humano, cuya cabeza ha crecido en relación a sus ancestros.
Para compensar el parto dificultoso, los bebés nacen más pequeños e indefensos.
12 - Control del fuego

¿Hace 1 millón de años?
Nadie sabe cuándo nuestros ancestros aprendieron a controlar el fuego.
La prueba directa más antigua proviene de la Cueva Wonderwerk, en Sudáfrica, que contiene cenizas y huesos quemados de hace 1 millón de años.
Pero hay evidencias de que los homínidos procesaban los alimentos incluso antes y de que eso podía incluir cocinar con fuego.
13 – El don de la charla

Hace 1,6 millones – 600.000
Todos los grandes homínidos tienen sacos de aire en sus tractos vocales que les permiten lanzar fuertes bramidos.
Pero los humanos no, porque esos sacos de aire hacen que sea imposible producir diferentes sonidos vocales.
Nuestros ancestros los perdieron aparentemente antes de que nos bifurcáramos de nuestros primos Neandertales, lo que sugiere que ellos también podían hablar.
14 - Un gen para el lenguaje

Hace 500.000 años
Algunas personas tienen una mutación en un gen llamado FOXP2.
Como resultado, les cuesta entender gramática y pronunciar palabras.
Eso sugiere que FOXP2 es crucial para aprender y usar el lenguaje.
El gen moderno se desarrolló en el ancestro común de los humanos y los Neandertales: el FOXP2 neandertal es igual al nuestro.
15 – Saliva reforzada para comer carbohidratos

La saliva contiene una enzima llamada amilasa, fabricada por el gen AMY1, que digiere el almidón.
Los humanos modernos cuyos ancestros fueron agricultores tienen más copias AMY1 que aquellos cuyos ancestros siguieron siendo cazadores recolectores.
Este refuerzo digestivo puede haber ayudado para dar inicio a los cultivos, los poblados y las sociedades modernas.

:format(jpeg)/cloudfront-us-east-1.images.arcpublishing.com/elespectador/4FQGFJQTXFCQZNXAYQVMLLLVRE.jpg)




















/sdmedia.playser.cadenaser.com/playser/20241/26/1706260869121_1706260869_video_1706260938.jpg)
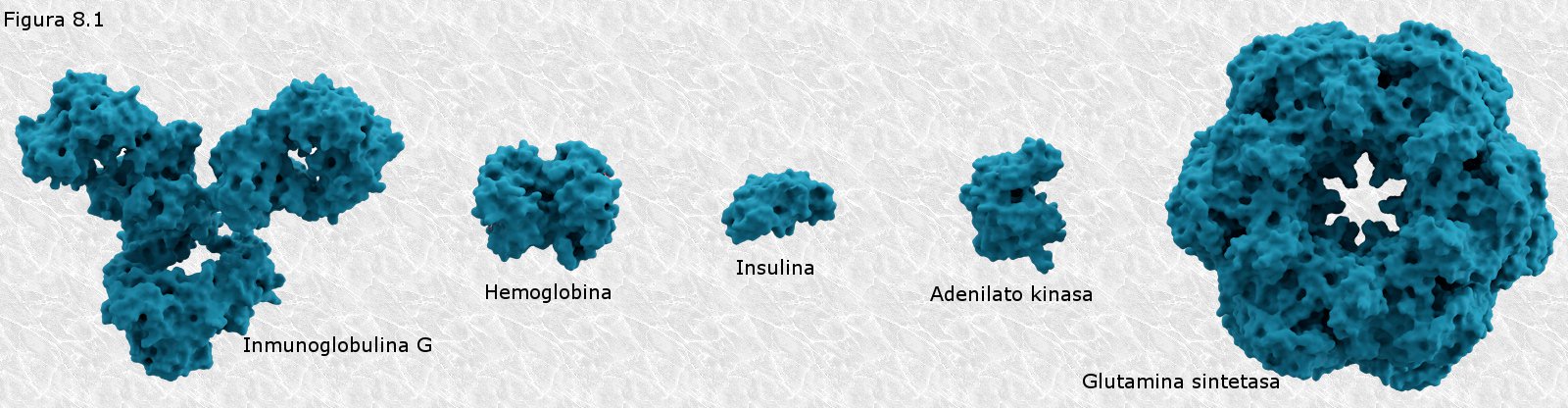
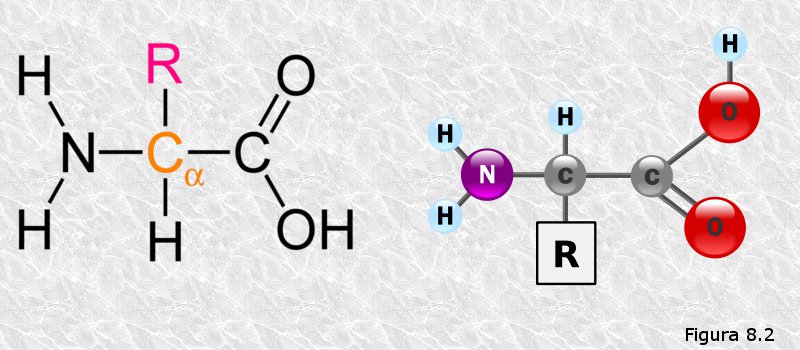
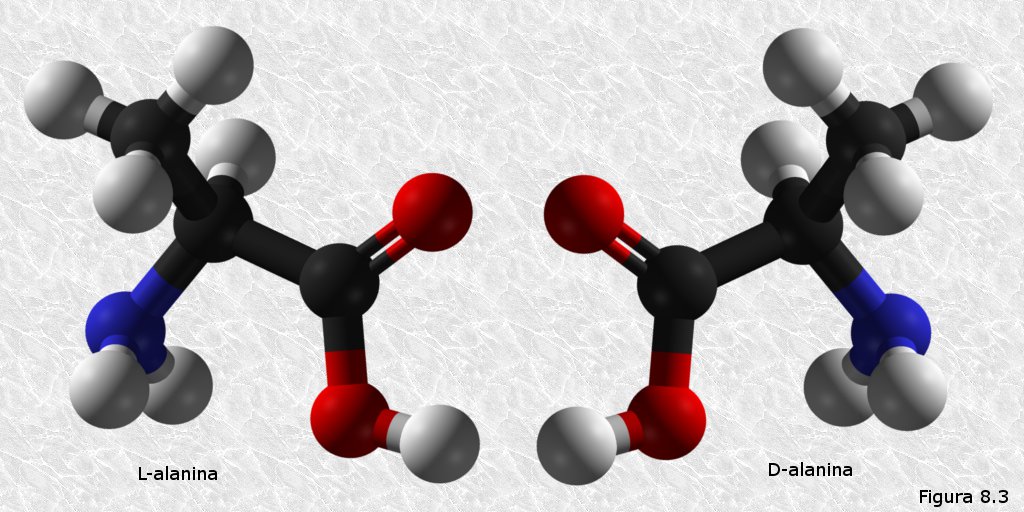
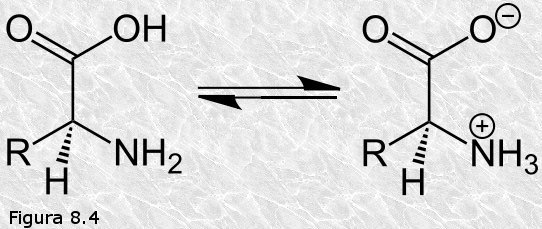
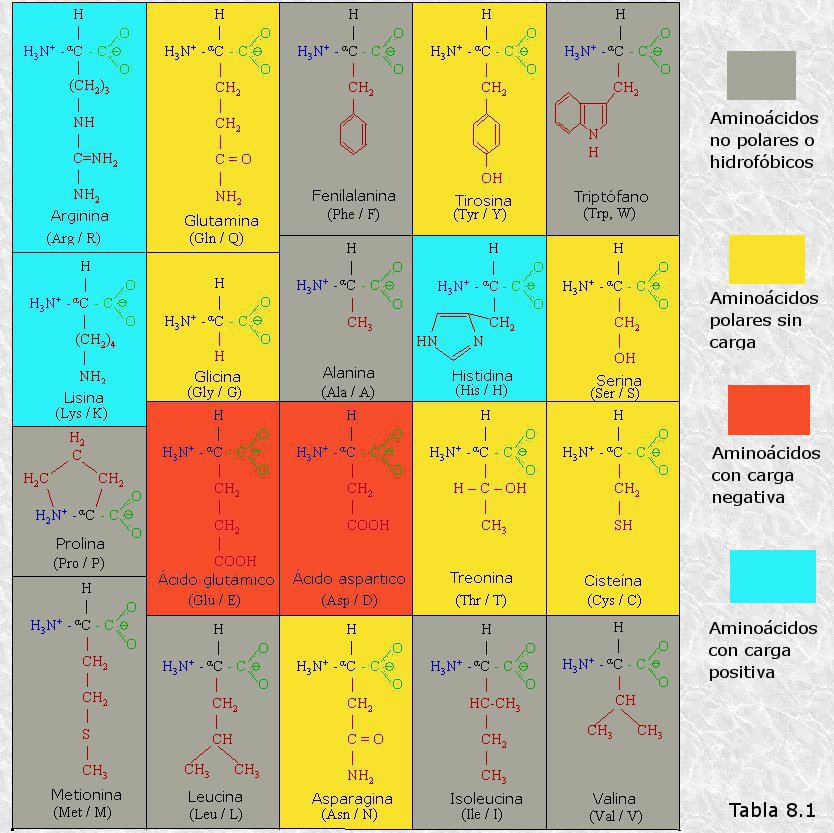
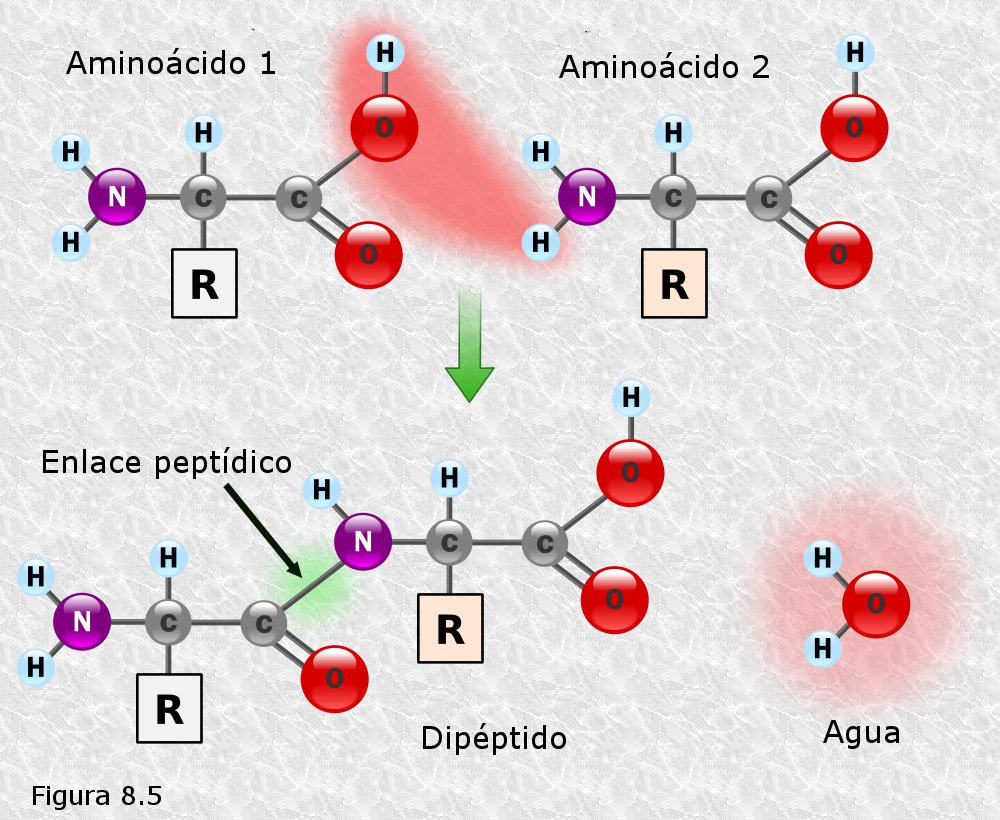
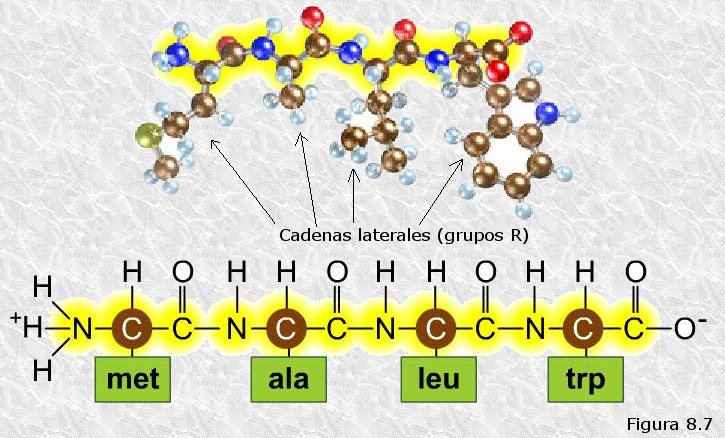

 inicialmente mediante la técnica de difracción de rayos X (basada en la capacidad de los átomos de difractar los RX en función de su tamaño). Esta técnica es aplicable al análisis de estructuras cristalinas, sin embargo, la microscopía electrónica reveló que las proteínas fibrosas presentaban estructuras repetitivas que eran susceptibles de análisis mediante esta técnica.
inicialmente mediante la técnica de difracción de rayos X (basada en la capacidad de los átomos de difractar los RX en función de su tamaño). Esta técnica es aplicable al análisis de estructuras cristalinas, sin embargo, la microscopía electrónica reveló que las proteínas fibrosas presentaban estructuras repetitivas que eran susceptibles de análisis mediante esta técnica.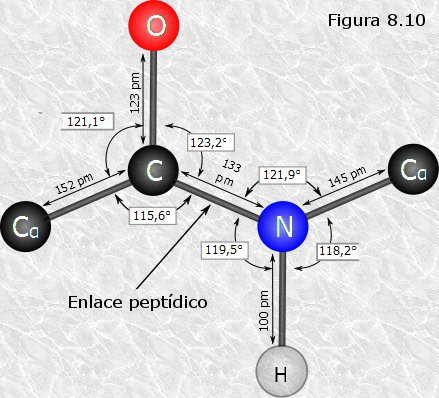 resonancia un par de electrones del doble enlace C-O. El carácter parcial de doble enlace impide que el enlace peptídico pueda girar sobre sí mismo; los cuatro átomos del grupo peptídico son coplanares, estando el oxígeno y el hidrógeno en posición trans (Figura 8.10). Esta falta de libertad de giro supone una primera restricción en el número de conformaciones posibles de la cadena polipeptídica, que estaría entonces constituida por una serie de planos rígidos formados por los diferentes grupos peptídicos, los cuales podrían adoptar diferentes posiciones unos con respecto a otros mediante giros de los enlaces sencillos que flanquean cada uno de estos planos (ver Figura 8.11).
resonancia un par de electrones del doble enlace C-O. El carácter parcial de doble enlace impide que el enlace peptídico pueda girar sobre sí mismo; los cuatro átomos del grupo peptídico son coplanares, estando el oxígeno y el hidrógeno en posición trans (Figura 8.10). Esta falta de libertad de giro supone una primera restricción en el número de conformaciones posibles de la cadena polipeptídica, que estaría entonces constituida por una serie de planos rígidos formados por los diferentes grupos peptídicos, los cuales podrían adoptar diferentes posiciones unos con respecto a otros mediante giros de los enlaces sencillos que flanquean cada uno de estos planos (ver Figura 8.11).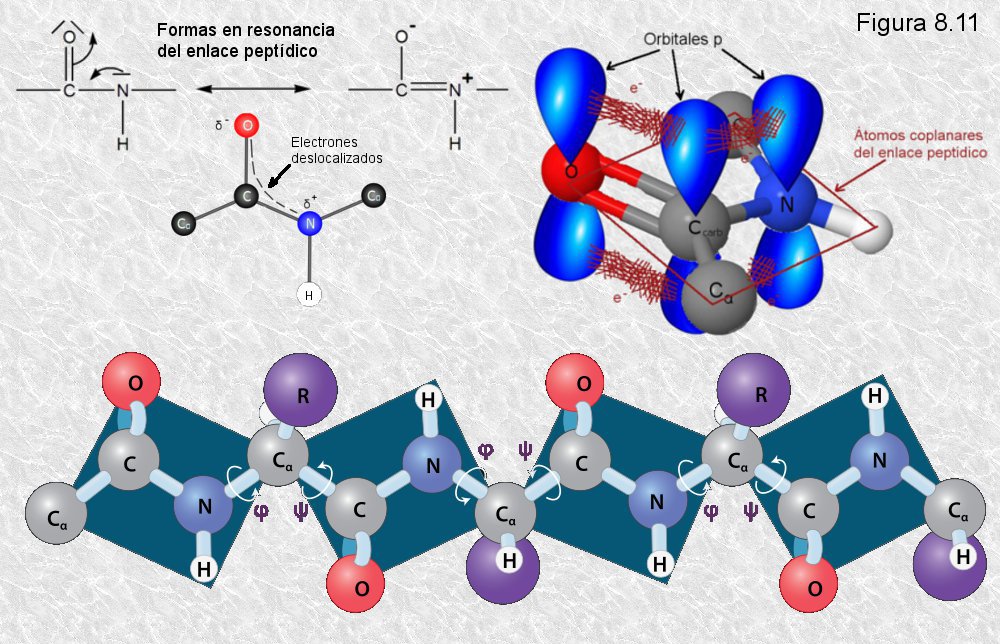
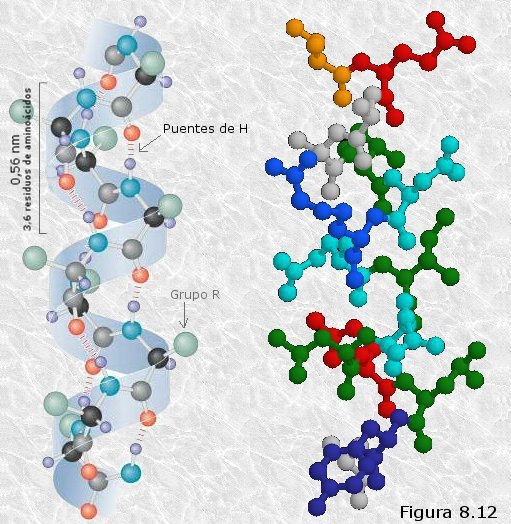
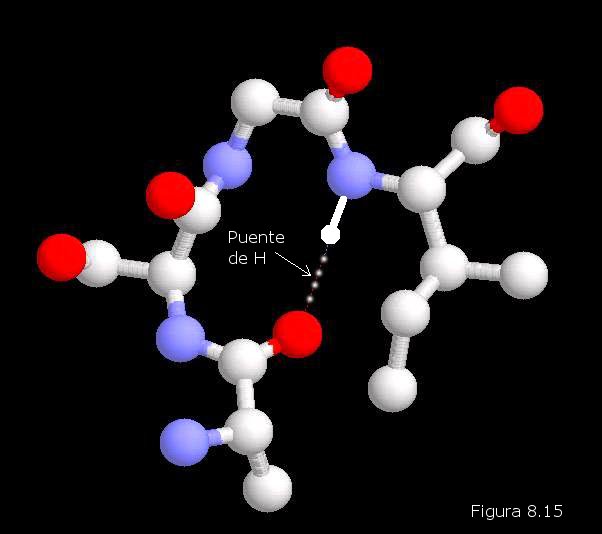
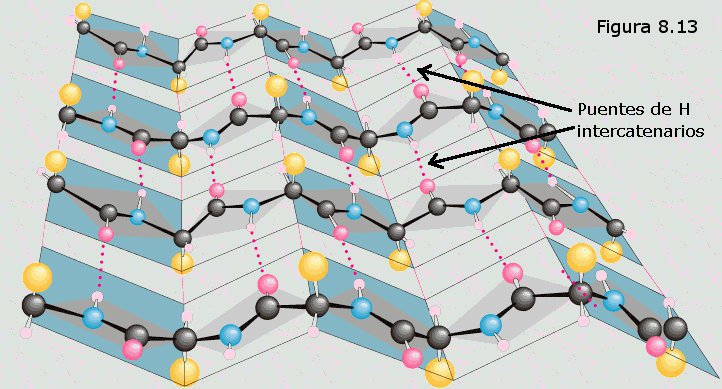 de longitud de la cadena, coincidiendo con la periodicidad observada por DRX. Muchas de estas cadenas colocadas paralelamente unas a otras forman una estructura que recuerda a una hoja de papel plegada, en la que los grupos R de los aminoácidos se encuentran sobresaliendo por ambas caras de dicha hoja. En este caso, los grupos peptídicos de los diferentes restos aminoácidos establecen puentes de hidrógeno con los de las cadenas vecinas (puentes de hidrógeno intercatenarios).
de longitud de la cadena, coincidiendo con la periodicidad observada por DRX. Muchas de estas cadenas colocadas paralelamente unas a otras forman una estructura que recuerda a una hoja de papel plegada, en la que los grupos R de los aminoácidos se encuentran sobresaliendo por ambas caras de dicha hoja. En este caso, los grupos peptídicos de los diferentes restos aminoácidos establecen puentes de hidrógeno con los de las cadenas vecinas (puentes de hidrógeno intercatenarios).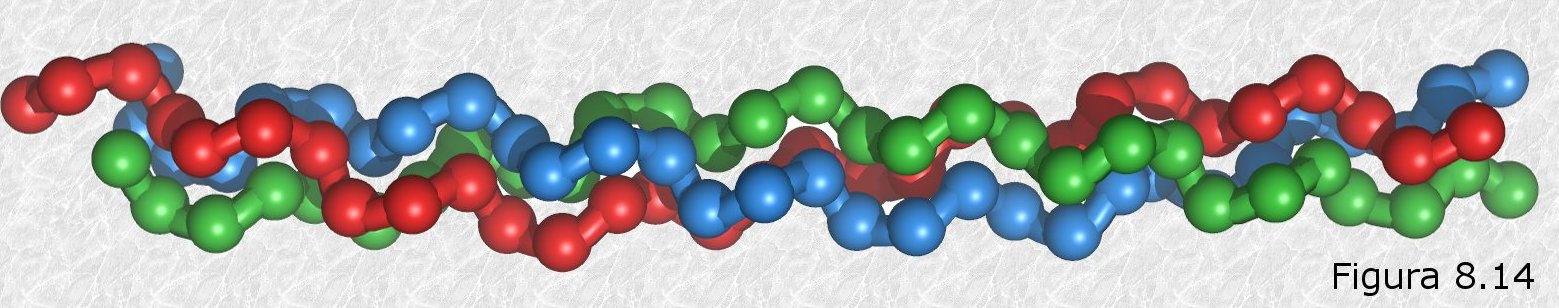

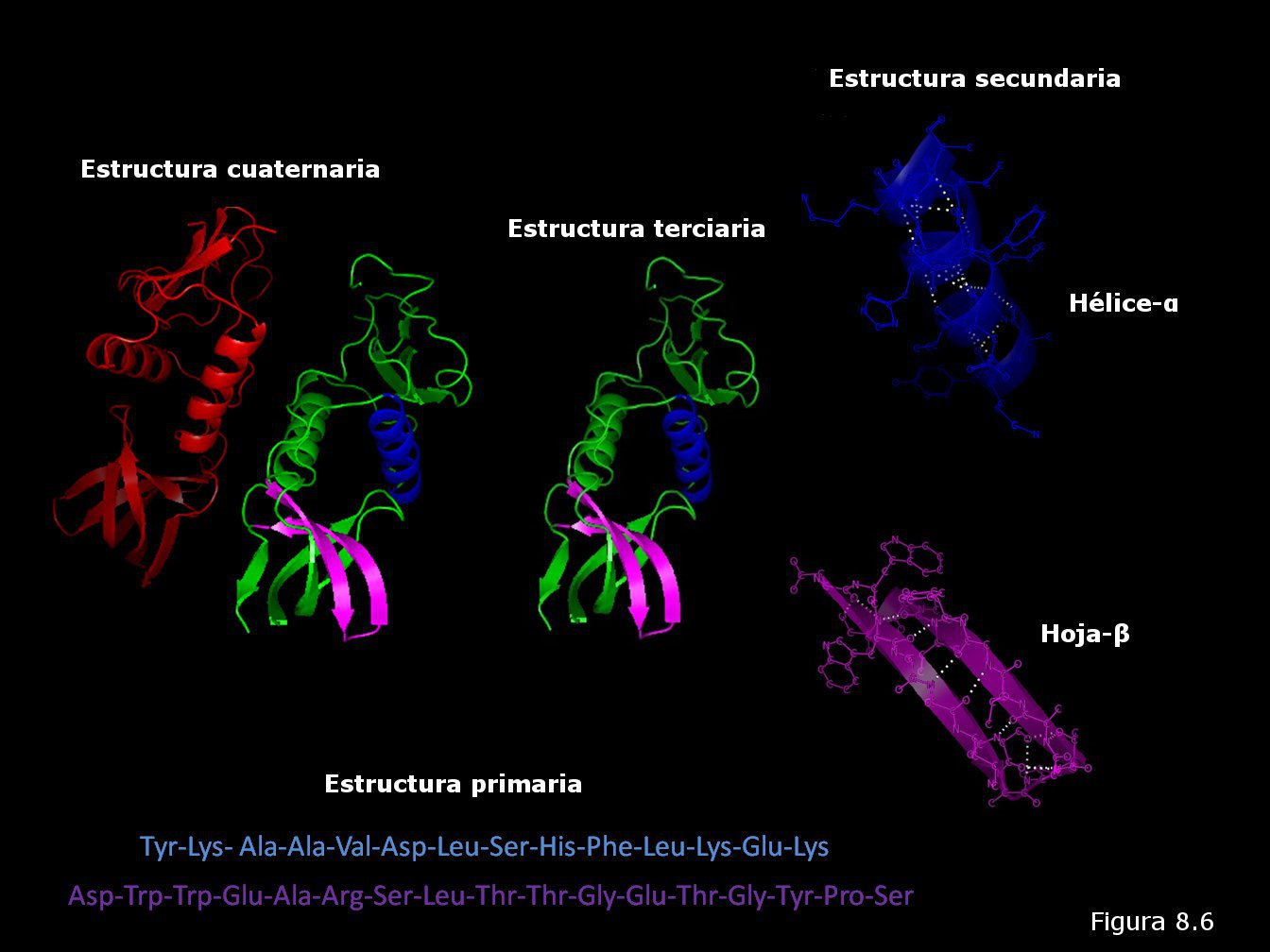
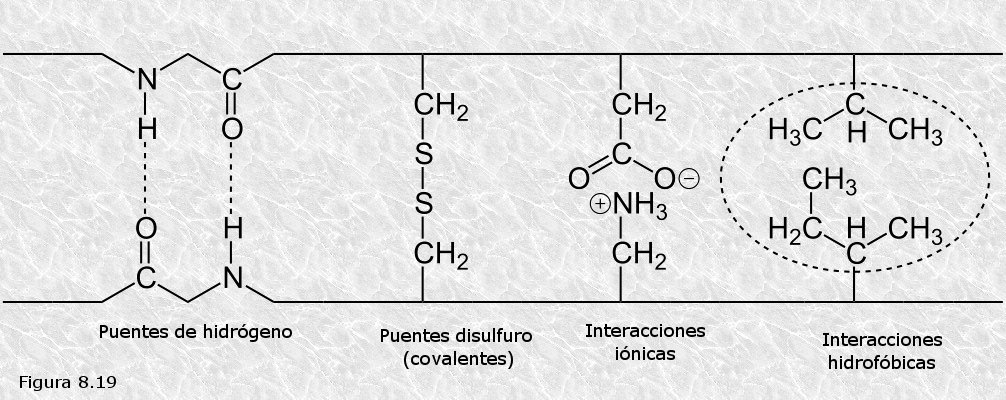
 proteínas producían. Véase la Figura 8.16). Los cristalógrafos ingleses John Kendrew y Max Perutz (Figura 8.16b) obtuvieron grandes éxitos en la elucidación de la estructura tridimensional de proteínas globulares. La primera proteína cuya estructura terciaria fue conocida fue la mioglobina (una proteína que transporta oxígeno en el músculo), concretamente la del cachalote (ver Figura 8.17). En ella se pueden apreciar ocho segmentos rectilíneos con estructura secundaria en hélice α separados por curvaturas sin estructura secundaria aparente. Alrededor del 70% de la cadena polipeptídica se encuentra en las regiones plegadas en hélice α. La molécula es muy compacta, sin apenas espacio para moléculas de agua en su interior. Los grupos R de residuos aminoácidos con carácter polar o iónico se proyectan hacia la periferia de la molécula, mientras que los de carácter no polar se encuentran enterrados en el interior de la misma, aislados del contacto con el agua. La estructura se encuentra estabilizada por diferentes tipos de interacciones débiles entre los grupos R de diferentes aminoácidos; estas interacciones son de largo alcance, afectando a grupos R de residuos aminoácidos que pueden ocupar posiciones muy alejadas en la cadena polipeptídica.
proteínas producían. Véase la Figura 8.16). Los cristalógrafos ingleses John Kendrew y Max Perutz (Figura 8.16b) obtuvieron grandes éxitos en la elucidación de la estructura tridimensional de proteínas globulares. La primera proteína cuya estructura terciaria fue conocida fue la mioglobina (una proteína que transporta oxígeno en el músculo), concretamente la del cachalote (ver Figura 8.17). En ella se pueden apreciar ocho segmentos rectilíneos con estructura secundaria en hélice α separados por curvaturas sin estructura secundaria aparente. Alrededor del 70% de la cadena polipeptídica se encuentra en las regiones plegadas en hélice α. La molécula es muy compacta, sin apenas espacio para moléculas de agua en su interior. Los grupos R de residuos aminoácidos con carácter polar o iónico se proyectan hacia la periferia de la molécula, mientras que los de carácter no polar se encuentran enterrados en el interior de la misma, aislados del contacto con el agua. La estructura se encuentra estabilizada por diferentes tipos de interacciones débiles entre los grupos R de diferentes aminoácidos; estas interacciones son de largo alcance, afectando a grupos R de residuos aminoácidos que pueden ocupar posiciones muy alejadas en la cadena polipeptídica.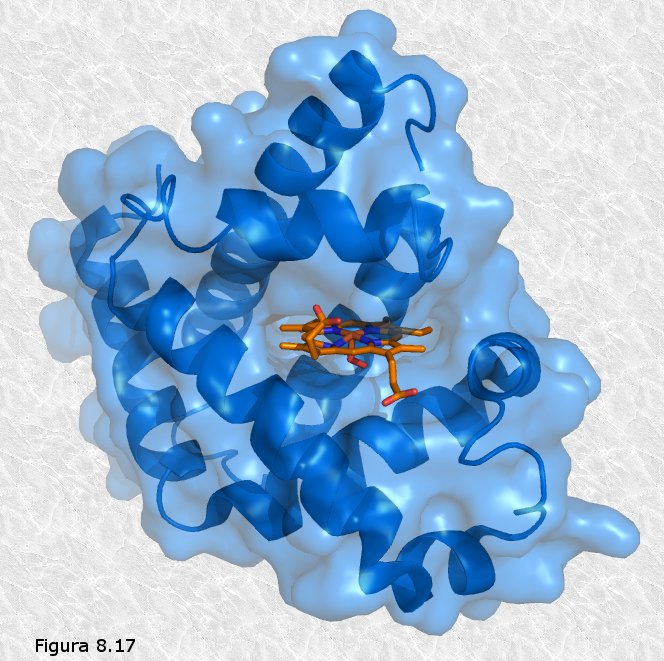
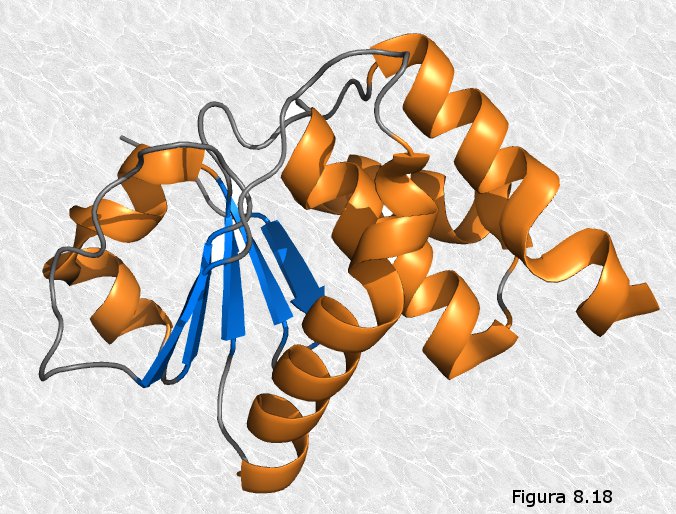
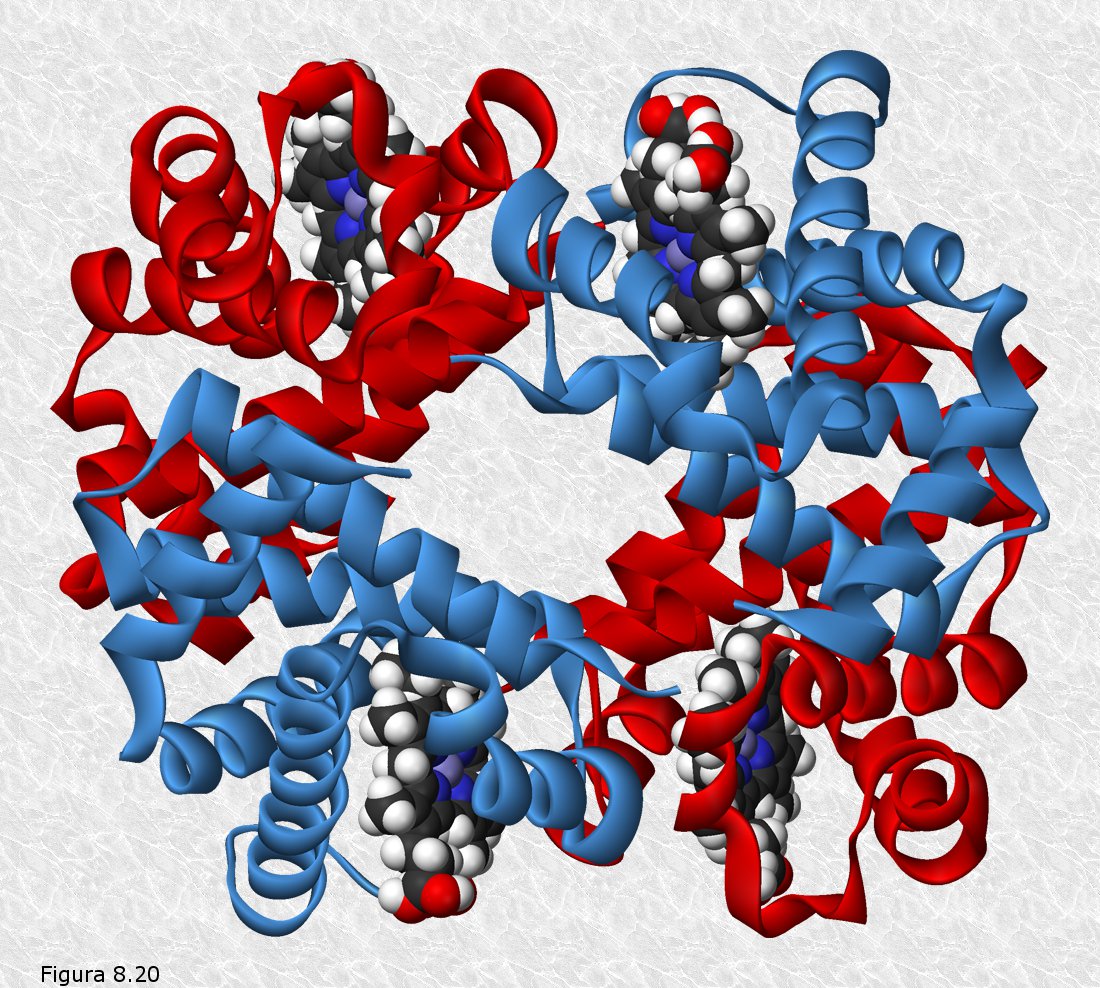
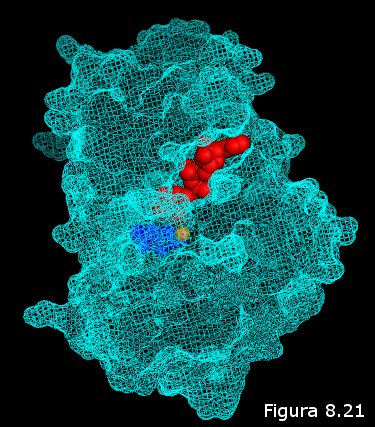 cerradura (ver Figura 8.21). Sólo aquel o aquellos ligandos capaces de acoplarse en el centro activo de la proteína serán susceptibles de interactuar con ella. Hay que tener en cuenta que este acoplamiento no es meramente espacial, sino que la proteína "ve" en su ligando, además de la forma, la distribución de cargas eléctricas, sus distintos grupos funcionales, y, en general, las posibilidades de establecer interacciones débiles con él a través de los grupos R de los aminoácidos que rodean el centro activo (el ligando "atraca" en el centro activo como lo haría un barco en un muelle, se establecen entre ambos "amarras" en forma de interacciones débiles que hacen más estable la asociación).
cerradura (ver Figura 8.21). Sólo aquel o aquellos ligandos capaces de acoplarse en el centro activo de la proteína serán susceptibles de interactuar con ella. Hay que tener en cuenta que este acoplamiento no es meramente espacial, sino que la proteína "ve" en su ligando, además de la forma, la distribución de cargas eléctricas, sus distintos grupos funcionales, y, en general, las posibilidades de establecer interacciones débiles con él a través de los grupos R de los aminoácidos que rodean el centro activo (el ligando "atraca" en el centro activo como lo haría un barco en un muelle, se establecen entre ambos "amarras" en forma de interacciones débiles que hacen más estable la asociación).