Los factores que afectan la actividad enzimática son aquellos agentes o condiciones que pueden modificar el funcionamiento de las enzimas. Las enzimas son una clase de proteínas cuya función es acelerar las reacciones bioquímicas. Estas biomoléculas son esenciales para todas las formas de vida, plantas, hongos, bacterias, protistas y animales.
Las enzimas son esenciales en diversas reacciones importantes para los organismos, como eliminar compuestos tóxicos, descomponer los alimentos y generar energía.

Así, las enzimas son como máquinas moleculares que facilitan las tareas de las células y, en muchas ocasiones su funcionamiento se ve afectado o favorecido bajo ciertas condiciones.
Concentración de enzimas
A medida que aumenta la concentración de enzimas, la velocidad de la reacción aumenta de manera proporcional. Sin embargo, esto es así solo hasta cierta concentración, pues en un momento determinado la velocidad se hace constante.
Esta propiedad se utiliza para determinar las actividades de las enzimas séricas (del suero sanguíneo) para el diagnóstico de enfermedades.
Concentración de sustratoAl aumentar la concentración de sustrato se incrementa la velocidad de la reacción. Esto se debe a que más moléculas de sustrato colisionarán con las moléculas de enzima, por lo que se formará el producto más rápidamente.
No obstante, al superar cierta concentración de sustrato no habrá ningún efecto sobre la velocidad de la reacción, pues la enzimas estarían saturadas y funcionando a su máxima velocidad.
pH
Los cambios en la concentración de iones hidrógeno (pH) influyen considerablemente en la actividad de las enzimas. Debido a que estos iones poseen carga, generan fuerzas de atracción y repulsión entre los enlaces de hidrógeno e iónicos de las enzimas. Esta interferencia produce cambios en la forma de las enzimas, afectando así su actividad.
Cada enzima tiene un pH óptimo en el que la velocidad de reacción es máxima. Así, el pH óptimo para una enzima depende de dónde funciona normalmente.
Por ejemplo, las enzimas intestinales tienen un pH óptimo de aproximadamente 7.5 (ligeramente básico). En contraste, las enzimas en el estómago tienen un pH óptimo de aproximadamente 2 (muy ácido).
Salinidad
La concentración de sales también afecta el potencial iónico y en consecuencia pueden interferir en ciertos enlaces de las enzimas, los cuales pueden formar parte del sitio activo de la misma. En estos casos, al igual que con el pH, la actividad enzimática se verá afectada.
Temperatura
A medida que aumenta la temperatura aumenta la actividad enzimática y, en consecuencia, la velocidad de la reacción. Sin embargo, las temperaturas muy altas desnaturalizan las enzimas, esto significa que el exceso de energía rompe los enlaces que mantienen su estructura haciendo que no funcionen de manera óptima.
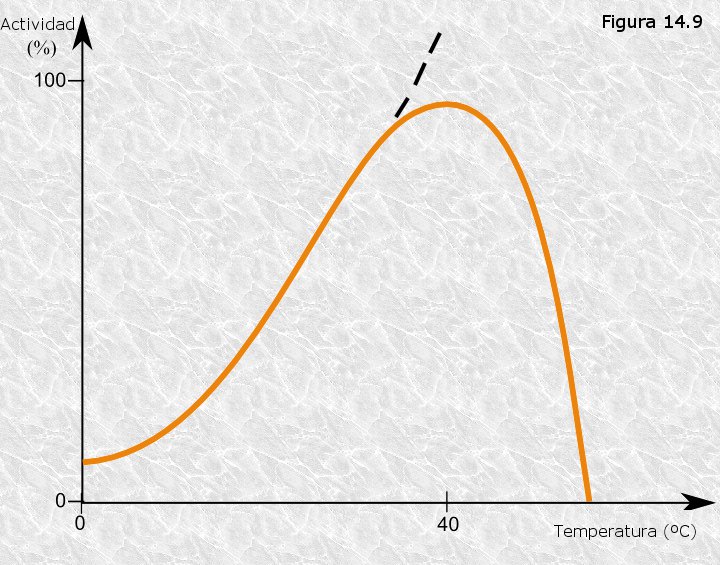
Así, la velocidad de la reacción disminuye rápidamente a medida que la energía térmica desnaturaliza las enzimas. Este efecto se puede observar de manera gráfica en una curva en forma de campana, donde se relaciona la velocidad de reacción con la temperatura.
La temperatura a la que se produce la velocidad máxima de reacción se denomina temperatura óptima de la enzima, que se observa en el punto más alto de la curva.
Este valor es diferente para las distintas enzimas. No obstante, la mayoría de las enzimas en el cuerpo humano tienen una temperatura óptima de alrededor de 37.0 °C.
En resumen, a medida que aumenta la temperatura, inicialmente la velocidad de reacción aumentará debido al aumento de la energía cinética. Sin embargo, el efecto de la ruptura de la unión será cada vez mayor, y la velocidad de reacción comenzará a disminuir.
Concentración del producto
La acumulación de los productos de reacción generalmente disminuye la velocidad de la enzima. En algunas enzimas, los productos se combinan con su sitio activo formando un complejo suelto y, por lo tanto, inhibiendo la actividad de la enzima.
En sistemas vivos, este tipo de inhibición generalmente se previene mediante una eliminación rápida de los productos formados.
Activadores enzimáticos
Algunas de las enzimas requieren la presencia de otros elementos para funcionar mejor, estos pueden ser cationes metálicos inorgánicos como Mg2+, Mn2+, Zn2+, Ca2+, Co2+, Cu2+, Na+, K+, etc.
En raras ocasiones, también se necesitan aniones para la actividad enzimática, por ejemplo: el anión cloruro (CI-) para la amilasa. Estos pequeños iones se denominan cofactores enzimáticos.
También existe otro grupo de elementos que favorecen la actividad de las enzimas, llamados coenzimas. Las coenzimas son moléculas orgánicas que contienen carbono, como las vitaminas que se encuentran en los alimentos.
Un ejemplo sería la vitamina B12, que es la coenzima de la metionina sintasa, una enzima necesaria para el metabolismo de las proteínas en el cuerpo.
Inhibidores enzimáticos
Los inhibidores enzimáticos son sustancias que afectan negativamente la función de las enzimas y, en consecuencia, ralentizan o en algunos casos, detienen la catálisis.
Hay tres tipos comunes de inhibición enzimática: competitiva, no competitiva e inhibición del sustrato:
Inhibidores competitivos
Un inhibidor competitivo es un compuesto químico similar a un sustrato que puede reaccionar con el sitio activo de la enzima. Cuando el sitio activo de una enzima se ha unido a un inhibidor competitivo, el sustrato no puede unirse a la enzima.Inhibidores no competitivosUn inhibidor no competitivo también es un compuesto químico que se une a otro lugar del sitio activo de una enzima, llamado sitio alostérico. En consecuencia, la enzima cambia de forma y ya no puede unirse fácilmente a su sustrato, por lo que la enzima no puede funcionar correctamente.
Las enzimas son esenciales en diversas reacciones importantes para los organismos, como eliminar compuestos tóxicos, descomponer los alimentos y generar energía.

Así, las enzimas son como máquinas moleculares que facilitan las tareas de las células y, en muchas ocasiones su funcionamiento se ve afectado o favorecido bajo ciertas condiciones.
Concentración de enzimas
A medida que aumenta la concentración de enzimas, la velocidad de la reacción aumenta de manera proporcional. Sin embargo, esto es así solo hasta cierta concentración, pues en un momento determinado la velocidad se hace constante.
Esta propiedad se utiliza para determinar las actividades de las enzimas séricas (del suero sanguíneo) para el diagnóstico de enfermedades.
Concentración de sustratoAl aumentar la concentración de sustrato se incrementa la velocidad de la reacción. Esto se debe a que más moléculas de sustrato colisionarán con las moléculas de enzima, por lo que se formará el producto más rápidamente.
No obstante, al superar cierta concentración de sustrato no habrá ningún efecto sobre la velocidad de la reacción, pues la enzimas estarían saturadas y funcionando a su máxima velocidad.
pH
Los cambios en la concentración de iones hidrógeno (pH) influyen considerablemente en la actividad de las enzimas. Debido a que estos iones poseen carga, generan fuerzas de atracción y repulsión entre los enlaces de hidrógeno e iónicos de las enzimas. Esta interferencia produce cambios en la forma de las enzimas, afectando así su actividad.
Cada enzima tiene un pH óptimo en el que la velocidad de reacción es máxima. Así, el pH óptimo para una enzima depende de dónde funciona normalmente.
Por ejemplo, las enzimas intestinales tienen un pH óptimo de aproximadamente 7.5 (ligeramente básico). En contraste, las enzimas en el estómago tienen un pH óptimo de aproximadamente 2 (muy ácido).
Salinidad
La concentración de sales también afecta el potencial iónico y en consecuencia pueden interferir en ciertos enlaces de las enzimas, los cuales pueden formar parte del sitio activo de la misma. En estos casos, al igual que con el pH, la actividad enzimática se verá afectada.
Temperatura
A medida que aumenta la temperatura aumenta la actividad enzimática y, en consecuencia, la velocidad de la reacción. Sin embargo, las temperaturas muy altas desnaturalizan las enzimas, esto significa que el exceso de energía rompe los enlaces que mantienen su estructura haciendo que no funcionen de manera óptima.
Así, la velocidad de la reacción disminuye rápidamente a medida que la energía térmica desnaturaliza las enzimas. Este efecto se puede observar de manera gráfica en una curva en forma de campana, donde se relaciona la velocidad de reacción con la temperatura.
La temperatura a la que se produce la velocidad máxima de reacción se denomina temperatura óptima de la enzima, que se observa en el punto más alto de la curva.
Este valor es diferente para las distintas enzimas. No obstante, la mayoría de las enzimas en el cuerpo humano tienen una temperatura óptima de alrededor de 37.0 °C.
En resumen, a medida que aumenta la temperatura, inicialmente la velocidad de reacción aumentará debido al aumento de la energía cinética. Sin embargo, el efecto de la ruptura de la unión será cada vez mayor, y la velocidad de reacción comenzará a disminuir.
Concentración del producto
La acumulación de los productos de reacción generalmente disminuye la velocidad de la enzima. En algunas enzimas, los productos se combinan con su sitio activo formando un complejo suelto y, por lo tanto, inhibiendo la actividad de la enzima.
En sistemas vivos, este tipo de inhibición generalmente se previene mediante una eliminación rápida de los productos formados.
Activadores enzimáticos
Algunas de las enzimas requieren la presencia de otros elementos para funcionar mejor, estos pueden ser cationes metálicos inorgánicos como Mg2+, Mn2+, Zn2+, Ca2+, Co2+, Cu2+, Na+, K+, etc.
En raras ocasiones, también se necesitan aniones para la actividad enzimática, por ejemplo: el anión cloruro (CI-) para la amilasa. Estos pequeños iones se denominan cofactores enzimáticos.
También existe otro grupo de elementos que favorecen la actividad de las enzimas, llamados coenzimas. Las coenzimas son moléculas orgánicas que contienen carbono, como las vitaminas que se encuentran en los alimentos.
Un ejemplo sería la vitamina B12, que es la coenzima de la metionina sintasa, una enzima necesaria para el metabolismo de las proteínas en el cuerpo.
Inhibidores enzimáticos
Los inhibidores enzimáticos son sustancias que afectan negativamente la función de las enzimas y, en consecuencia, ralentizan o en algunos casos, detienen la catálisis.
Hay tres tipos comunes de inhibición enzimática: competitiva, no competitiva e inhibición del sustrato:
Inhibidores competitivos
Un inhibidor competitivo es un compuesto químico similar a un sustrato que puede reaccionar con el sitio activo de la enzima. Cuando el sitio activo de una enzima se ha unido a un inhibidor competitivo, el sustrato no puede unirse a la enzima.Inhibidores no competitivosUn inhibidor no competitivo también es un compuesto químico que se une a otro lugar del sitio activo de una enzima, llamado sitio alostérico. En consecuencia, la enzima cambia de forma y ya no puede unirse fácilmente a su sustrato, por lo que la enzima no puede funcionar correctamente.


No hay comentarios:
Publicar un comentario